Por D. Ángel Rodriguez Villodres
Recuerdo que una vez la profesora de parasitología nos dijo: “Cuando un parásito puede permitirse vivir en la sangre y reproducirse, es porque dispone de mecanismos de parasitismo muy eficientes”, y tanto que sí. Os voy a hablar de un parásito que cuenta con una estrategia de evasión del sistema inmune realmente fascinante, y debido a la cual resulta prácticamente imposible fabricar una vacuna efectiva. Estoy hablando de Trypanosoma brucei.
T. brucei engloba a dos especies parásitas de humanos causantes de la tripanosomiasis africana, más conocida como “enfermedad del sueño”. Las dos especies patógenas para el hombre son T. brucei gambiense que causa la tripanosomiasis del África occidental (menos aguda) y T. brucei rhodesiense que causa la tripanosomiasis del África oriental (más aguda). Estas dos especies son morfológicamente indistinguibles.
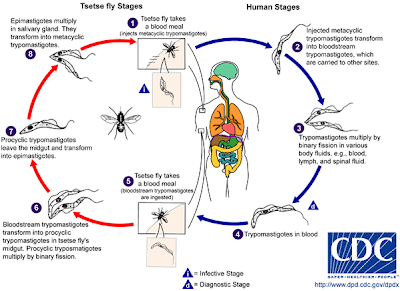
No os voy a explicar el ciclo biológico de T. brucei (figura 2), lo único importante a saber aquí es que el parásito cuenta con dos fases generales en su ciclo de vida, una que realiza en el interior de la mosca tse-tse y otra que se lleva a cabo en el torrente sanguíneo del ser humano (forma hemática).
 |
Figura 1. Células de T. brucei en sangre
humana. Vía wikimedia. Licencia CC.
Podéis encontrar más imágenes, así
como información acerca de este
parásito pinchando aquí.
|
Recuerdo que una vez la profesora de parasitología nos dijo: “Cuando un parásito puede permitirse vivir en la sangre y reproducirse, es porque dispone de mecanismos de parasitismo muy eficientes”, y tanto que sí. Os voy a hablar de un parásito que cuenta con una estrategia de evasión del sistema inmune realmente fascinante, y debido a la cual resulta prácticamente imposible fabricar una vacuna efectiva. Estoy hablando de Trypanosoma brucei.
T. brucei engloba a dos especies parásitas de humanos causantes de la tripanosomiasis africana, más conocida como “enfermedad del sueño”. Las dos especies patógenas para el hombre son T. brucei gambiense que causa la tripanosomiasis del África occidental (menos aguda) y T. brucei rhodesiense que causa la tripanosomiasis del África oriental (más aguda). Estas dos especies son morfológicamente indistinguibles.
No os voy a explicar el ciclo biológico de T. brucei (figura 2), lo único importante a saber aquí es que el parásito cuenta con dos fases generales en su ciclo de vida, una que realiza en el interior de la mosca tse-tse y otra que se lleva a cabo en el torrente sanguíneo del ser humano (forma hemática).
Hay dos modelos implicados en la conmutación de la VSG:
- Se puede dar un proceso de regulación transcripcional en el cual un ES activo es silenciado y un ES silenciado se vuelve transcripcionalmente activo. Este mecanismo solo es efectivo en las primeras fases de la infección, ya que solo permite acceder a la reserva limitada de los 15 sitios de expresión (ES).
- El otro mecanismo está basado en reacciones de recombinación que mueven los genes VSG silenciados a los sitios de expresión. Se sabe que tres vías de recombinación son las que contribuyen al cambio de VSG.
1. Conversión génica, donde un gen de VSG subtelomérico y silenciado es copiado y transferido a un sitio de expresión (ES) activo, reemplazando al gen de VSG antiguo.
2. Intercambio recíproco entre los telómeros, donde se produce un entrecruzamiento entre los extremos de los cromosomas de forma que se mueve un VSG telomérico a un ES activo y el VSG previamente activo se moviliza al otro cromosoma (inactivo).
3. Combinación de porciones de al menos dos pseudogenes para producir un VSG mosaico. Esta vía permitiría generar nuevas glicoproteínas, aunque hay discusiones acerca de la importancia que tiene.
Aquí se exponen de forma general cómo suceden estos procesos, pero lo cierto es que no están esclarecidos totalmente y la realidad resulta todavía más compleja.
¿Y todo esto a qué viene? Pues a que, como se ha dicho antes, aunque la VSG sea muy antigénica y fácilmente reconocible por el sistema inmunitario del ser humano, la conmutación que llevan a cabo los genes de esta glicoproteína hace que cualquier vacunación sea imposible. Por eso es necesario buscar vías alternativas para atacar a este parásito.
Recientemente se ha encontrado un receptor de inositol 1,4,5-trifosfato (IP3) en unos compartimentos celulares de T. brucei denominados “acidocalcisomas”, el cual difiere considerablemente del receptor de IP3 que se encuentra en los mamíferos. Este receptor actúa liberando calcio al citosol, y parece ser esencial para el crecimiento y el establecimiento de una infección eficiente por parte del parásito. Una de las posibles vías de tratamiento se podría dirigir hacia el bloqueo de este receptor, aunque aún se necesita investigación adicional para poder obtener resultados concluyentes.
Asimismo, la aclaración de los mecanismos subyacentes de la conmutación de la VSG podría revelar vías bioquímicas diferentes de las del hospedador que sean susceptibles de ser atacadas.
Aunque poco a poco se están descubriendo posibles dianas a través de las cuales hacer frente a este parásito, aún no hay conclusiones claras y se necesita investigación adicional hasta poder establecer las bases de un posible tratamiento; y así, con un poco de suerte, acabar con una enfermedad que seguramente, y esta es mi opinión, si se diera con más frecuencia en nuestro mal llamado primer mundo nos recordaría a una historia de otro tiempo.
REFERENCIAS
- Horn D, McCulloch R (2010). Molecular mechanisms underlying the control of antigenic variation in African trypanosomes. Current Opinion in Microbiology. 13: 700-705.
- Huang G, Bartlett P J, Thomas A P, Silvia N, Moreno J, Docampo R. (2013). Acidocalcisomes of Trypanosoma brucei have an inositol 1,4,5-triphosphate receptor that is required for growth and infectivity. PNAS 110(5) : 1887-1892.
- Manna P T, Kelly S, Field M C (2013). Adaptin evolution in kinetoplastids and emergence of the variant surface glycoprotein coat in African trypanosomatids. Molecular phylogenetics and evolution. DOI: http://dx.doi.org/10.1016/j.ympev.2013.01.002.
- Morrison L J, Marcello L, McCulloch R (2009). Antigenic variation in the African trypanosome: molecular mechanisms and phenotypic complexity. Celular Microbiology 11(12): 1724-1734.
- Navarro M, Peñate X, Landeira D (2007). Nuclear architecture underlying gene expression in Trypanosoma brucei. Trends in Microbiology. 15(6): 263-270.
- Rudenko G (2011). African trypanosomes: the genome and adaptations for immune evasion. Essays Biochem. 51: 47-62.
- Rudenko G (2010). Epigenetics and transcriptional control in African trypanosomes. Essays Biochem. 48: 201-219.
- Schwede A, Carrington M (2010). Bloodstream form trypanosome plasma membrane proteins: antigenic variation and invariant antigens. Parasitology. 137: 2029-2039.







No hay comentarios:
Publicar un comentario